martes, 10 de mayo de 2011
lunes, 9 de mayo de 2011
2. BOHR-EN EREDU ATOMIKOA
Bohrren eredu atomikoa Niels Bohrrek proposatutako eredu atomikoa da, Rutherforden urre xafla saiakuntzan lortutako emaitzetan oinarrituta. Rutherfordenaren antzera, planetarioa da, hau da, erdian positiboki kargaturiko nukleo bat dauka eta elektroiek, beraien karga negatiboarekin, nukleo honi biraka dabiltza. Erakarpen hori gainditzeko modu bat da nukleoaren inguruan etengabe biraka ibiltzea,
eguzki-sistemako planetei gertatzen zaien antzera.
Plancken energiaren izaera kuantikoan oinarrituta, Bohrrek elektroien orbitak diskretuak direla proposatu zuen, hau da, elektroien orbitak energia zehatz batzuk bakarrik izan ditzakete eta ez dute batere energiarik galtzen. Aurreko honengatik ez dira nukleorantz erortzen, Rutherforden eredua zioen bezalaxe.
Honen arabera, esan dezakegu, elektroiak eta haien orbitak geruzatan antolatzen direla, baina duten energiaren kopuruaren arabera. Hau kontuan hartuta geruza hauei, energia-maila deituko diegu.
Energia-mailen antolaketa:
 Lehenbiziko energia-maila: 2 elektroi.
Lehenbiziko energia-maila: 2 elektroi.- Bigarren energia-maila: 8 elektroi.
- Hirugarren energia-maila: 18 elektroi.
- Laugarren energia-mailan: 32 elektroi.
Elektroiek atomoan jartzeko, libre dauden mailetatik energia gutxienekoa hartzen dute lehenbizi eta hartatik urrunduz joaten dira.
Zenbat eta energia-maila handiagoa, nukleotik orduan eta hurrunago: nukleotik hurbilen dagoen maila lehenbizikoa da; haren ondorengoa bigarrena; eta abar.
Konkluzioz: Bohr-en ereduaren arabera, elektroiak energia-maila jakinetan soilik ibil daitezke biraka.
domingo, 8 de mayo de 2011
6. ATOMOEN ARTEKO LOTURA MOTAK
6.ATOMOEN ARTEKO LOTURA MOTAK
Atomoek beraien artean lotzen dira, sistema egonkorragoak osatzeko.
Atomoak elkartuta mantentzen dituen loturari lotura kimikoa esaten zaio. Mantetzen duen lotura indar elektrikoak dira eta zenbait mota daude, elkarren artean lotzen diren atomoak nolakoak diren.
1.1.Lotura ionikoak
Metal bet eta ez-metal bat lotzen direnean gertatzen da.
Metalak elektriak ematen ditu eta katioi bihurtzen da; ez-metalak elektroiak hartzen ditu eta anioi bihurtzen da.
Zeinu desberdinetako ioien artean gertatzen da, zeinu desberdinetako kargek elkar erakartzen baitute.
- Na-k bere balentzia-elektroia ematen du eta gas geldoen konfigurazioa hartzen du. Na+ ioi bihurtzen da.Cl-k elektroi bat hartuz gas geldoen konfigurazioa lortzen du; Cl- bihurtzen da. Na atomo bat eta Cl atomo bat elkartzen dira eta NaCl sortzen da.
Konposatu ioniko orotan formulak adierazten digu zer proportzioetan dauden atomoak. Ez dira molekula bakarturik eratzen eta solido kristalinoak dira.
Substantzia ionikoak solidoak dira giro-tenperaturan, eta irakite-puntu nahiz urtze-puntu altuak dituzte.
6.2.Lotura kobalenteak Bi ez-metal elkartzen direnean gertatzen da. Ez-metalek elektroiak hartu behar dituzte, eta hori lortzeko modu bakarra beraien artean partekatzea da. Bi atomoen nukleoek elektroi horiek erakartzen dituzte.
Elementuen ikurrak erabiltzen zirela loturak adierazteko, eta puntuak, balentzia-elektriak adierazteko. Elektroi parea adierazteko, marra bat egiten da atomoen artean esan zuen Lewisek.
-Cl atomo bakoitza 7 balentzia-elektroi ditu; bi atomoen artean elektroi pare bat partekatzen badute, gas geldoen konfigurazioa lortzen dute.
Adibidez: Cl2
-Bi elementu ez-metalikoen artean ere sortzen dira lotura kobalenteak.
Adibidez: H2O eta CH4
6.3. Lotura metalikoa
Metalak elkartzen direnean gertatzen da.
Metalen atomoek electroiak eman behar dituzte gas geldoen kofigurazioa lortzeko. Metalek balentzia-elektroiak ematen dituzte eta nukleo positiboen artean elektroi-hodeia sortzen da.
Lotura metalikoa sortzen da ioi positiboen arteko erakarpenaren ondorioz.
Elektriak higikortasuna dute; oso elektrizitate-eroale dira metalak. Elektroi-hodeiak itsasgarri modura jokatzen du katioiaren artean. Ia metal guztiak solidoak dira giro-tenperaturan, eta urtze nahiz irakite-puntu altuak dituzte.
GILBERT N. LEWIS:
Estatubatuar fisikari eta kimikari bat izan zen.
Hau proposatu zuen bi atomo elektriak partekatzen dituztenean sor daitezkeela lotura kimikoak.
sábado, 7 de mayo de 2011
1. ATOMOAREN OSAERA
Materiaren oinarri den estruktura mikroskopikoa da. Atomo bat ezin da metodo kimikoen bitartez zatitu.
Atomoa nukleo oso txikia du, atomo osoaren neurrian kontuan hartuz gero.
- Nukleoan protoiak eta neutroiak daude
- Nukleoaren inguruan elektroiak ibiltzen dira biraka, nukleotik oso urrun, haren neurriak kontuan izanda. Ia, atomo osoa hutsik dago.
- Quark izeneko partikulez osatuta daude neutroiak eta protoiak
masa | karga | |
Protoia | Positiboa, 1,6·10- | Handia, 1,67·10- |
Neutroia | Neutroa | Handia, 1,67·10- |
Elektroia | Negatiboa, -1,6·10- | Txikia, 9,1·10- |
Atomoak adierazteko, ikur bat eta bi zenbaki erabiltzen dira:
- Zenbaki atomikoa Z: protoi kopurua adierazten du
- Masa-zenbakia A: guztira zenbat protoi eta neutroi dituen adierazten du.
Adibidez, har dezagun 11 protoi eta 12 neutroi dituen sodio atomo neutro bat. Haren zenbaki atomikoa 11 da (hau da, protoi kopurua) eta masa-zenbakia 23 da (11 protoi + 12 neutroi). Ondorioz, honela adierazten da:
Isotopo:deritze protoi kopuru berbera baina neutroi kopuru desberdina duten atomoi. Isotopo guztiak elementu kimiko berberaren atomoak dira, denak Z berbera dute.
Atomoa izendatzeko, elementuaren izena adierazten da eta gero masa-zenbakia.
Izena | Argona-36 edo Ar-36 | Argona-38 edo Ar-38 | Argona-40 edo Ar-40 |
Z | 18 | 18 | 18 |
A | 36 | 38 | 40 |
Protoiak | 18 | 18 | 18 |
Elektroiak | 18 | 18 | 18 |
Neutroiak | A-Z=36-18=18 | A-Z=38-18=20 | A-Z=40-18=22 |
BERRIKUSKETA
ATOMOA
Materiaren oinarri den estruktura mikroskopikoa da. Atomo bat ezin da metodo kimikoen bitartez zatitu.
Atomo baten existentzia proposatu zuen lehenengoa Demokrito izan zen.
Demokritok esaten zuen lau atomo mota zeudela:
- lur atomoa: astuna eta hortzduna
- ur atomoa: astuna leuna eta esferikoa
- aire atomoa: arina eta hotza zen
- su atomoa: arinak eta beroak
Daltonen teoria:
- Materia etena da. Partikula material independenteek osatzen dute, eta atomo izena dute partikula horiek; zatiezinak dira.
- Elementu bereko atomoak berdinak dira, bai masari eta baita ezaugarri fisiko eta kimikoei dagokienez ere.
- Elementu ezberdinetako atomoak ezberdinak dira masari eta gainerako propietateei dagokienez.
- Elementu konposatuak elementu jakin batzuen atomoen loturari esker sortzen dira, zenbakizko erlazio erraz baten bitartez.
- Atomoen barnealdean partikula txikiago batzuk daude, materiak propietate elektrikoak izatea eragiten dutenak: elektroiak
Thomson:
1897. urtean, deskarga-hodiak erabiliz, esperimentu bat egin zuen.
Polo positiboa duen hodi bat polo negatiboa duen beste batekin elkartzean deskarga elektrikoak eragiten ziren.
Esperimentu honekin frogatu zuen atomoetan elektroiak daudela,
karga elektriko negatibo duena.
Robert Millikan:
1909an olio tantatxoekin esperimentatu zuen elektroien karga, 1,6× 10-27 C
Materia neutroa denez, karga positiboak ere badaude, negatiboen kantitate bera.
 |
| Rutherford-en atomoa |
Protoia aurkitu zuen. Elektrioak eta protoiak karga bera dute baina, positiboa. Masa desberdina dute, elektroiak baino 1840 aldiz handiagoa.
James Chadwick kargarik gabeko beste partikula bat aurkitu zuen, neutroia.
QUARK
Gaur egun aurkitu den atomoen partikula txikiagoa da, eta protoiak eta neutroiak osatzen dutenak.
§ up (goia)
§ down (behea)
§ bottom (hondoa)
EREDU ATOMIKOAK
 1803an Dalton-ek (1766-1844) bere teoria atomikoa aurkezten du. Teoria horrek ordura arte ezagutzen ziren kimikari buruzko legeak azaltzen ditu. Daltonen lan hori XX. mende hasiera arte zientzialariek onartu egin zuten, baina garai hartan egin ziren aurkikuntza berriek teoria berriak garatu beharra eragin zuen.
1803an Dalton-ek (1766-1844) bere teoria atomikoa aurkezten du. Teoria horrek ordura arte ezagutzen ziren kimikari buruzko legeak azaltzen ditu. Daltonen lan hori XX. mende hasiera arte zientzialariek onartu egin zuten, baina garai hartan egin ziren aurkikuntza berriek teoria berriak garatu beharra eragin zuen.Daltonen teoria atomikoa
Daltonen teoria atomikoa ondorengo gaietan laburbil dezakegu:
- Materia etena da. Partikula material independenteek osatzen dute, eta atomo izena dute partikula horiek; zatiezinak dira.
- Elementu bereko atomoak berdinak dira, bai masari eta baita ezaugarri fisiko eta kimikoei dagokienez ere.
- Elementu ezberdinetako atomoak ezberdinak dira masari eta gainerako propietateei dagokienez.
- Elementu konposatuak elementu jakin batzuen atomoen loturari esker sortzen dira, zenbakizko erlazio erraz baten bitartez.
Thomson-en eredu atomikoa
 Thomsonen (1856-1940) eredu atomikoaren arabera, karga positibodun esfera batek osatzen du atomoa. Esfera horretan dago atomoaren zatirik handiena, eta bertan daude elektroiak txertatuta.
Thomsonen (1856-1940) eredu atomikoaren arabera, karga positibodun esfera batek osatzen du atomoa. Esfera horretan dago atomoaren zatirik handiena, eta bertan daude elektroiak txertatuta.ALFA IZPIEN AURKIKUNTZA
XIX. mendearen bukaeran frantses fisikari bat, Henry Bequerel (1852-1908), ohartu zen uranio-mineral batek igortzen zuela erradiazioa. Hura aztertzeari ekin zioten orduan, eta ikusi zuten egiatan hiru erradiazio mota daudela, eta haietako bat, alfa izpiak, enegia handiko eta karga positiboko partikulez (helioaz, hain zuzen) osatuta dagoela. Fenomeno horri erradioaktibitate deritzo.
Erradioaktibitatearekin loturiko webguneak:
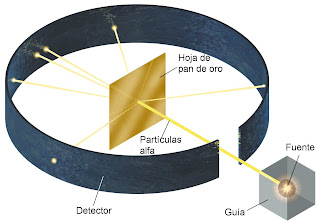
URREZKO XAFLAREN ESPERIMENTUA
Berunezko bloke baten barnean barrunbe bat egin zuten, kanpoalderako irtenbide eta guzti, eta alfa izpiak sortzen zituen material erradioaktiboa jarri zuten barruan. Kanporako zuloaren noranzko bera ez zuten izpi guztiak berunak xurgatuko zituzkeen. Horrela, material erradioaktibotik bertatik zuzenean ateratako izpiak soilik iristen ziren urrezko xaflara.
Alfa izpiek urrezko xaflara jo ondoren zer ibilbide egiten zuten jakiteko, argazki-film bat jarri zuten urrezko xaflaren inguruan.
Esperimentua egin ondoren emaitza hauek lortu zituzten:
- Alfa partikula gehienek batere desbideratu gabe zeharkatu zuten urrezko xafla.
- Partikula gutxi batzuk apurtxo bat desbideratu ziren xafla zeharkatu ondoren.
- 10.000 alfa partikuletatik batek xaflan errebotatu eta atzerantz egin zuen.
Rutherforden eredua
Atomoaren barnean nukleo bat dago, txiki-txikia atomo osoaren aldean. Nukleoan dago atomoaren karga positibo osoa, eta nukleoaren inguruan elektroiak dabiltza, etengabe biraka.
Rutherforden atomoa
Rutherforden ereduak bete-betean azaltzen du urrezko xaflaren esperimentua.

- Ia atomo osoa hutsik dago, eta elektroiak nukleoaren inguruan daude biraka. Horregatik, urrezko xaflara iristen diren alfa partikula gehienek batere desbideratu gabe zeharkatzen dute hura, inolako oztoporik baitute bidean.
- Partikula guztietatik gutxi batzuk nukleotik gertu pasatzen dira, eta horregatik, desbideratu egiten dira.
- Oso partiklua gutxik jotzen dute nukleoa, eta horiexek soilik errebotatzen dute.
Ioiak
miércoles, 4 de mayo de 2011
4.Taula Periodikoa
4. Taula Periodikoa:
4.1. Taula Periodikoa
Taula Periodokoak, elementua kimikoak: sailkatu, antolatu eta kokatzen ditu bere propietateeen eta ezaugarrien arabera.
Normalean pentsatsen da Dimitri Mendeléyevek taula periodikoa egin zuela, baina elementuen ezaugarrien kimikoen eskuzko bariazioagatik antolatu zituen. Julius Lothar Meyer, berriz elementuak atomoen ezaugarrien fisikoen arabera antolatu zituen. Gaur egun erabiltzen dugun taula periodikoa Mendeléyeven aldarazpen bat da, Alfred Werner egina.
4.2 Elementuen aurkikuntza:
Nahiz eta urrea Au, zilarra Ag, kobrea Cu, beruna Pb eta merkurioa Hg ezagunak izan aitzin-aintzinatik, elementu baten lehenengoko aurkikuntza zientifikoa XVII mendean gertatu zen. Henning Brand alkimistak fosforoa P aurkitu zuen. Urte horietan Antoine Lavoisierrek bere lista famatua egin zuen. Bertan 33 elementu sinple zeuden.
1830. urtean 55 elemantu ezagunak ziren. Ondoren XIX. mendean, espektroskopioa asmatu egin zen. Aurrerakuntza handia izan zen hori esker elementu berriak aurkitu zirelako. Elementu berrieri bere marren espektralen koloreagatik izena jarri zieten Adibidez: Zesioa ( Cs. Latineraz, caesius. urdina), Talioa (Tl, tallo esan nahi du, bere kolore berdeagatik), Rubidioa, (Rb, gorria)..
4.3. Elementuen sistema periodokoa:
Beheko taulak gaur egun ezagutzen ditugun elementu kimiko guztiak adierazten ditu. Elementuak antolatzeko modu horri sistema periodiko esaten zaio (taula periodikoa ere bai), eta zenbaki atomikoa Z txikienekotik handienekora adierazten dira elementu kimikoak.
Guztira 7 periodo daude (hilara horizontalak) eta 18 talde (zutabe bertikalak); eta elementu kimikoen konfigurazio, elektronikoaren arabera jartzen dira lauki jakin batean.
1 1. taldeko atomoek –alkalino izenekoek- elektroi bat dute azken mailan. Konfigurazioa: ns1. Elektroi bat galdu egin behar dute, konfigurazio egonkorra lortzeko; hura galtzean, +1 kargako ioi bat bihurtzen da.
2 2. taldeko atomoek –lurralkalino deritzenek- bi elektroi dituzte azken mailan. Konfigurazioa: ns2. Bi elektroi galdu egin behar dituzte, konfigurazio egonkorragoa lortzeko; hala, elektroiak galtzean, +2 kargako ioi bihurtzen da.
3 13. taldeko atomoek –boroide izenekoek- 3 elektroi dituzte azken mailan. Konfigurazioa: ns2 np1. Hiru elektroi horiek galtzen badituzte, aurreko gas geldoaren konfigurazio egonkorra izango dute. Beraz, +3 kargako ioi bihurtzeko joera dute.
4 14. taldeko atomoek –karbonoide deritzenek- 4 elektroi dituzte azken mailan. Konfigurazio hau dute: ns2 np2. Gas geldoek adina elektroi izateko, lau elektroi hartu edo galdu behar dituzte; hala, -4 edo +4 kargako ioi bihurtzen dira.
5 15. taldeko atomoek –nitrogenoide izenekoek-5 elektroi dituzte azken mailan. Konfigurazioa: ns2 np3. Hiru elektroi hartu behar dituzte, hurrengo gas geldoaren konfigurazio egonkorra izateko; hala, -3 kargako ioi bihurtzen dira.
6 16. taldeko atomoek –anfigeno izenekoak- 6 elektrio dituzte azken mailan. Konfigurazioa: ns2 np4. Bi elktroi hartu egin behar dituzte
7 17. taldeko atomoek –halogeno deritzenek- 7 elektroi dituzte azken mailan. Konfigurazioa: ns2 np5. Elektroi bat hartu behar dute hurrengo gas geldoaren konfigurazio egonkorra izateko; hala, -1 kargako ioi bihurtzen dira.
8 18. taldeko atomoei gas geldo esaten zaie. 8 elektroi dituzte azken mailan. Konfigurazioa: ns2 np6. Ez dute elektroi hartzen ez galtzen, eta horrenbestez, taula periodikoko elementurik egonkorrenak dira
A 1. taldeko eta 2. taldeko elementu guztiak metalak dira. +1 eta +2 ioiak eratzen dituzte, hurrenez hurren.
B 3. taldetik 12. taldera bitarteko elementuei trantsiziozko metal esaten zaie: Haietako batzuk metaltzat jo ohi ditugunak dira; esate baterako, urrea, kobrea eta burdina.
C 13. taldetik 17. taldera bitartean, elementuen izaera metalikoa gero eta handiagoa da, taldeetan beherantz egin ahala. Adibidez 13. taldean, denak metalak dira, boroa izan ezik; 16 taldean, denak ez metalak dira, polonioa izan ezik; eta 17. taldean –halogenoenean- denak ez metalak dira.
Suscribirse a:
Comentarios (Atom)