ATOMOA
Materiaren oinarri den estruktura mikroskopikoa da. Atomo bat ezin da metodo kimikoen bitartez zatitu.
Atomo baten existentzia proposatu zuen lehenengoa Demokrito izan zen.
Demokritok esaten zuen lau atomo mota zeudela:
- lur atomoa: astuna eta hortzduna
- ur atomoa: astuna leuna eta esferikoa
- aire atomoa: arina eta hotza zen
- su atomoa: arinak eta beroak
Daltonen teoria:
- Materia etena da. Partikula material independenteek osatzen dute, eta atomo izena dute partikula horiek; zatiezinak dira.
- Elementu bereko atomoak berdinak dira, bai masari eta baita ezaugarri fisiko eta kimikoei dagokienez ere.
- Elementu ezberdinetako atomoak ezberdinak dira masari eta gainerako propietateei dagokienez.
- Elementu konposatuak elementu jakin batzuen atomoen loturari esker sortzen dira, zenbakizko erlazio erraz baten bitartez.
- Atomoen barnealdean partikula txikiago batzuk daude, materiak propietate elektrikoak izatea eragiten dutenak: elektroiak
Thomson:
1897. urtean, deskarga-hodiak erabiliz, esperimentu bat egin zuen.
Polo positiboa duen hodi bat polo negatiboa duen beste batekin elkartzean deskarga elektrikoak eragiten ziren.
Esperimentu honekin frogatu zuen atomoetan elektroiak daudela,
karga elektriko negatibo duena.
Robert Millikan:
1909an olio tantatxoekin esperimentatu zuen elektroien karga, 1,6× 10-27 C
Materia neutroa denez, karga positiboak ere badaude, negatiboen kantitate bera.
 |
| Rutherford-en atomoa |
Protoia aurkitu zuen. Elektrioak eta protoiak karga bera dute baina, positiboa. Masa desberdina dute, elektroiak baino 1840 aldiz handiagoa.
James Chadwick kargarik gabeko beste partikula bat aurkitu zuen, neutroia.
QUARK
Gaur egun aurkitu den atomoen partikula txikiagoa da, eta protoiak eta neutroiak osatzen dutenak.
§ up (goia)
§ down (behea)
§ bottom (hondoa)
EREDU ATOMIKOAK
 1803an Dalton-ek (1766-1844) bere teoria atomikoa aurkezten du. Teoria horrek ordura arte ezagutzen ziren kimikari buruzko legeak azaltzen ditu. Daltonen lan hori XX. mende hasiera arte zientzialariek onartu egin zuten, baina garai hartan egin ziren aurkikuntza berriek teoria berriak garatu beharra eragin zuen.
1803an Dalton-ek (1766-1844) bere teoria atomikoa aurkezten du. Teoria horrek ordura arte ezagutzen ziren kimikari buruzko legeak azaltzen ditu. Daltonen lan hori XX. mende hasiera arte zientzialariek onartu egin zuten, baina garai hartan egin ziren aurkikuntza berriek teoria berriak garatu beharra eragin zuen.Daltonen teoria atomikoa
Daltonen teoria atomikoa ondorengo gaietan laburbil dezakegu:
- Materia etena da. Partikula material independenteek osatzen dute, eta atomo izena dute partikula horiek; zatiezinak dira.
- Elementu bereko atomoak berdinak dira, bai masari eta baita ezaugarri fisiko eta kimikoei dagokienez ere.
- Elementu ezberdinetako atomoak ezberdinak dira masari eta gainerako propietateei dagokienez.
- Elementu konposatuak elementu jakin batzuen atomoen loturari esker sortzen dira, zenbakizko erlazio erraz baten bitartez.
Thomson-en eredu atomikoa
 Thomsonen (1856-1940) eredu atomikoaren arabera, karga positibodun esfera batek osatzen du atomoa. Esfera horretan dago atomoaren zatirik handiena, eta bertan daude elektroiak txertatuta.
Thomsonen (1856-1940) eredu atomikoaren arabera, karga positibodun esfera batek osatzen du atomoa. Esfera horretan dago atomoaren zatirik handiena, eta bertan daude elektroiak txertatuta.ALFA IZPIEN AURKIKUNTZA
XIX. mendearen bukaeran frantses fisikari bat, Henry Bequerel (1852-1908), ohartu zen uranio-mineral batek igortzen zuela erradiazioa. Hura aztertzeari ekin zioten orduan, eta ikusi zuten egiatan hiru erradiazio mota daudela, eta haietako bat, alfa izpiak, enegia handiko eta karga positiboko partikulez (helioaz, hain zuzen) osatuta dagoela. Fenomeno horri erradioaktibitate deritzo.
Erradioaktibitatearekin loturiko webguneak:
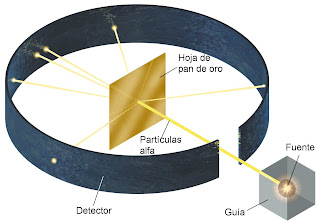
URREZKO XAFLAREN ESPERIMENTUA
Berunezko bloke baten barnean barrunbe bat egin zuten, kanpoalderako irtenbide eta guzti, eta alfa izpiak sortzen zituen material erradioaktiboa jarri zuten barruan. Kanporako zuloaren noranzko bera ez zuten izpi guztiak berunak xurgatuko zituzkeen. Horrela, material erradioaktibotik bertatik zuzenean ateratako izpiak soilik iristen ziren urrezko xaflara.
Alfa izpiek urrezko xaflara jo ondoren zer ibilbide egiten zuten jakiteko, argazki-film bat jarri zuten urrezko xaflaren inguruan.
Esperimentua egin ondoren emaitza hauek lortu zituzten:
- Alfa partikula gehienek batere desbideratu gabe zeharkatu zuten urrezko xafla.
- Partikula gutxi batzuk apurtxo bat desbideratu ziren xafla zeharkatu ondoren.
- 10.000 alfa partikuletatik batek xaflan errebotatu eta atzerantz egin zuen.
Rutherforden eredua
Atomoaren barnean nukleo bat dago, txiki-txikia atomo osoaren aldean. Nukleoan dago atomoaren karga positibo osoa, eta nukleoaren inguruan elektroiak dabiltza, etengabe biraka.
Rutherforden atomoa
Rutherforden ereduak bete-betean azaltzen du urrezko xaflaren esperimentua.

- Ia atomo osoa hutsik dago, eta elektroiak nukleoaren inguruan daude biraka. Horregatik, urrezko xaflara iristen diren alfa partikula gehienek batere desbideratu gabe zeharkatzen dute hura, inolako oztoporik baitute bidean.
- Partikula guztietatik gutxi batzuk nukleotik gertu pasatzen dira, eta horregatik, desbideratu egiten dira.
- Oso partiklua gutxik jotzen dute nukleoa, eta horiexek soilik errebotatzen dute.
Ioiak







No hay comentarios:
Publicar un comentario